
咨询电话:400-027-6118

咨询电话:400-027-6118

电解或电池体系都是二电极体系,只有正负极,那为什么在电化学测试过程中要选择三电极体系呢?其原因是在电化学测试过程中,我们需要研究的是单个电极(即工作电极),如果选择二电极体系 ,那我们就默认把对电极(又称为辅助电极)作为参考(一般所说的电极电势都是相对电极电势),而事实上一旦体系中有电流通过,对电极就会发生极化,导致电位的变化,这样工作电极所测到的电位就不准了。那有人会问了:选择可逆性高的电极作为对电极不就行了吗?确实,如果有理想可逆电极的话或许可以,但现实是一般选用的参比电极只能在电流很小的情况下才是可逆的,而且二电极体系还存在电流流过时溶液电压降的问题,因此三电极体系显然是首选。那么三电极体系的原理是什么呢?见下图。工作电极和对电极构成回路,对电极只是起到电流导通的作用,而参比电极用来作为测量或施加工作电极电位的基准,因此工作电极的电位也就是相对于参比电极的电势了。
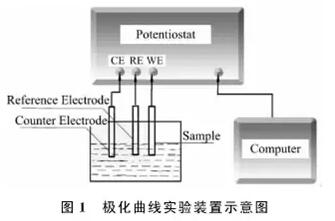
如上所述,三电极体系包括工作电极、对电极和参比电极,那么它们的选择标准又是什么呢?下面我们就来详细谈一谈。
1. 工作电极
一般的工作电极需满足以下三个条件:
①所研究的电化学反应不会因电极自身所发生的反应而受到影响,并且能够在较大的电位区域中进行测定。
②电极必须不与溶剂或电解液组分发生反应。
③电极面积不宜太大,电极表面最好是均一平滑,且能够通过简单的方法进行表面净化。
常见的“惰性”固体电极有玻碳、铂、金、银、铅、导电玻璃(FTO,ITO等)。常用的液体电极有液态汞。采用固体电极时,为了保证实验的重现性,需注意建立合适的电极预处理步骤。
2.辅助电极(counter electrode)
辅助电极也叫对电极,其作用是和工作电极组成一个串联回路,只起到导电的作用。
在电化学研究中经常选用性质比较稳定的材料,比如铂或者石墨。(在需要长时间电化学实验的体系中最好选择石墨电极,因为最近的很多文献表明,当选用Pt做对电极时,长时间的测试往往会使Pt溶解,工作电极在扫描的过程中会沉积Pt,从而可能会影响工作电极的活性)
为了减少辅助电极极化对工作电极的影响,辅助电极本身的电阻要小,并且不易极化,其面积通常要求大于工作电极。其原因是在相同的电流下,如果电极面积大,那么电流密度小,根据B-V方程,其过电位小,极化小,因此电化学工作站的灵敏度高,干扰小。反过来说,当工作电极的面积非常小时,极化电流引起的辅助电极的极化可以忽略不计,即辅助电极的电势在测量中始终稳定,此时辅助电极可以作为测量回路中的电势基准,即可作为参比电极。例如,研究超微电极时,可用二电极体系就可以完成测量。
3. 参比电极(reference electrode)
一般的工作电极需满足以下三个条件:
①电极电势已知且稳定,重现性好的可逆电极。即电极过程的交换电流密度相当高,是不极化或难极化电极,因此能迅速建立热力学平衡电位,其电极电势符合Nernst方程。
②参比电极内的电解液不与电解池中的电解液或相关物质反应。
③电极电位的温度系数小。
④参比电极中的电解液离子渗透到溶液中不会影响工作电极的反应。
常用的参比电极有:饱和甘汞电极(SCE)(见图3)、Ag/AgCl电极、可逆氢电极(RHE)、Hg/HgO电极、Hg/Hg2SO4电极等
一般在酸性或中性溶液中选择饱和甘汞电极(SCE)或Hg/Hg2SO4电极,在碱性溶液中选择Hg/HgO电极。当然如果使用盐桥,SCE在碱性溶液中也是可以使用的,前提是排除Cl离子对工作电极的影响。
在此介绍常用的两种参比电极:甘汞电极和银氯化银电极。
A. 甘汞电极(calomel electrode)
如图所示,电极电位与Cl离子的浓度有关,常用有三种浓度:0.1 mol/L、1.0 mol/L和饱和。最常用的是饱和甘汞电极(SCE),因为配置容易,溶液中至少保留少许KCl晶体,但温度系数较大,如果需要精密测量,可以用0.1 mol/L的,温度影响较小。
特点:(1)可逆性好,制作简单,常作为外参比电极。(2)使用温度较低(一般小于40摄氏度),受温度影响较大,如当T从20 oC 变到25 oC时,电位相差3.8 mV。(3)Hg离子可与一些离子反应,如在碱性溶液中,与氢氧根离子反应生成沉淀。
B. Ag/AgCl电极(silver chloride electrode)
特点:(1)可在高于60 oc(甚至可达275 oC)的温度下使用。(2)较少与其他离子反应导致堵塞。(3)常用作内参比电极(如PH计里使用的)。(4)如果失水干燥,容易导致AgCl脱落。